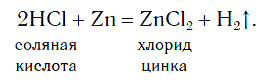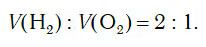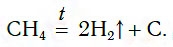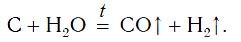FOR-DLE.ru
FOR-DLE.ru — Всё для твоего DLE 
Привет, я Стас! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект.
Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Практическая работа «Получение водорода в лаборатории и изучение его свойств». 8-й класс
Класс: 8
Презентации к уроку
Место урока: 8 класс. Тема II: Кислород, водород, вода как растворитель.
Тип урока: практическая работа
Задачи:
- Образовательная – совершенствовать экспериментальные умения — приемы работы с лабораторным оборудованием и веществами; умения наблюдать, делать выводы, оформлять результаты практической работы в тетради.
- Развивающая – работа над развитием навыков умелого обращения с огнем, опасными веществами.
- Воспитательная – расширение кругозора обучающихся, формирование уважения к истории науки.
- Здоровьесберегающая – развитие представлений о здоровом образе жизни в блоках: «Химия в быту — безопасное поведение»
Планируемые результаты обучения:
- Уметь работать с автоматическим прибором Кирюшкина для получения газов
- Уметь собирать газ методом вытеснения воды
- Уметь проверять горючий газ на чистоту
- Уметь делать правильные выводы из наблюдаемых опытов и характеризовать свойства водорода
Оборудование:
- Мультимедийная презентация 2 (Microsoft Power Point)
- Спецодежда — халат
- Наполняемость лабораторного лотка для ученика (13 шт.)
- лабораторный штатив с лапкой, держатель для пробирок, штатив для пробирок, ложка-дозатор, фильтровальная бумага
- спиртовка, спички
- автоматический прибор Кирюшкина для получения газов, 3 пробирки, кристаллизатор с водой
- гранулы цинка, соляная кислота (разб.), оксид меди (II)
- Наполняемость лабораторного лотка для учителя:
- лоток для ученика
- тигельные щипцы, стакан, стеклянная пластинка, стеклянная палочка
- «результаты» нарушений правил техники безопасности
Методы и приемы:
- Словесные (рассказ учителя, беседа).
- Наглядные (просмотр слайдов презентации; демонстрация приемов работы с лаборатор-ным оборудованием и веществами).
- Самостоятельная отработка учеником экспериментальных умений.
- Проблемно-поисковый.
Ход урока
(курсивом описаны действия учеников и учителя, особенности методики урока; обычным шрифтом – речь учителя)
I. Организационный момент (1 мин.)
отметить наличие халатов у всех учеников, проверить свободны ли от сумок проходы, убраны ли волосы у девочек. На столах оставить только ручки, калькуляторы и тетради.
II. Активизация знаний, необходимых для выполнения практической работы (13 мин.)
Слайд 1:
На этом уроке мы получим водород в лабораторных условиях. Это газообразное вещество; является взрывоопасным, если загрязнено воздухом, и поэтому требует к себе повышенного внимания.
Ученики одновременно с обсуждением расписываются в журнале техники безопасности.
Слайд 2:

На предыдущем уроке была проведена подготовка учеников к данной практической работе (Презентация 1) и задано домашнее задание:
Слайд 3:
Слайд проявляется постепенно, в соответствии с беседой
Вопросы:
- Какие исходные вещества будем использовать мы для получения водорода?
- Необходимо ли нагревать реакционную смесь?
- На что обратить внимание при записи наблюдений?
- Какой прибор будем использовать для получения водорода?
- Какими способами можно собрать водород, почему?
Слайд 4:
Слайд проявляется постепенно, в соответствии с беседой
Вопросы:
- Как доказать наличие водорода в пробирке-приёмнике?
- Какая химическая реакция происходит при этом?
- На что обратить внимание при записи наблюдений в данном пункте работы?
- Что из себя представляет гремучий газ?
Просмотр двух видеороликов.
Если взрыв произойдет в стеклянном сосуде, то осколки могут поранить окружающих и экспериментатора.
При проверке водорода на чистоту сжигают небольшой его объем (около 15 мл).
Возможный микровзрыв к травме привести не может.
Правило ТБ: пока нет убежденности, что газ из прибора выделяется чистый, держать отверстие газоотводной трубки подальше от пламени спиртовки.
Слайд 5:
Демонстрация результатов нарушений правил ТБ: пробирка с растресканным дном
Правило ТБ: нагревать пробирку необходимо в том месте, где находится твердое вещество, а не выше – где воздух. От неравномерного нагрева пробирка треснет.
пробирка со следами соляной кислоты в смеси с оксидом меди (II)
Правило ТБ: при зарядке автоматического прибора соляной кислотой нужно следить, чтобы не перелить кислоту (max 2 мл), иначе избыток от экзотермичности и бурного течения процесса попадет в газоотводную трубку.
III. Демонстрация эксперимента учителем (7 мин.)
Слайд 6
Слово учителя с элементами беседы
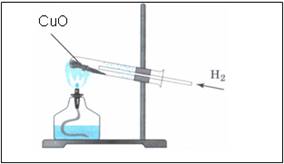
1. Взять ложкой-дозатором небольшое количество черного порошка оксида меди (II), поместить в пробирку, оставить в штативе для пробирок до проведения опыта по изучению восстановительных свойств водорода.
2. Закрепить автоматический прибор для получения газов в лапке штатива. Зарядить прибор исходными веществами: 4-5 гранул цинка поместить на резиновый кружок, через воронку прилить соляную кислоту так, чтобы ее слой над цинком был не более 2 мл. Прибор закрыть максимально герметично.
3. Для проверки газа на чистоту, мне приходится приготовить спиртовку заранее. Вы работаете вдвоем и зажжете спиртовку после того, как наберете газ в пробирку- приемник.
Правила ТБ: работа со спиртовкой
а) прежде чем зажечь спиртовку, нужно проверить плотно ли диск прилегает к отверстию резервуара (иначе искра может попасть в резервуар и весь объем спирта воспламенится)
б) зажигать только спичкой (нельзя использовать зажигалку, другую спиртовку)
в) спичку класть в лоток следует, убедившись, что она затушена (демонстрация нарушения правил ТБ – прожженный лоток)
г) чтобы погасить пламя, ее следует закрыть колпачком (задувать нельзя)
Выделяющийся водород собрать методом вытеснения воздуха, держа пробирку-приёмник вверх дном. Проверить газ на чистоту: зажать отверстие пробирки пальцем и поднести пробирку к пламени спиртовки, открыть ее.
4. Затем выделяющийся водород собрать методом вытеснения воды: набрать полную пробирку воды, перевернуть ее в кристаллизаторе и подвести к отверстию газоотводную трубку. Когда пробирка-приемник полностью заполнится водородом, зажать отверстие пальцем под водой. Убедиться в чистоте газа.
5. Закрепить пробирку с оксидом меди (II) в держателе.
Правила ТБ: закрепление пробирки в держателе
а) пробирку закрепляют в верхней третьей части ближе к отверстию
б) пробирка не должна выпадать, но проворачиваться (иначе при нагревании стекло расширяется и пробирка может лопнуть)
в) чтобы вынуть пробирку из держателя, нужно ослабить зажим.
Прогреть пробирку на пламени спиртовки 2-3 раза, далее нагревать ее в верхней части пламени, в том месте, где находится оксид меди (II). Внести газоотводную трубку с выделяющимся водородом.
После окончания опыта дать пробирке остыть, затем поставить в штатив для пробирок.
6. Потушить спиртовку, перекрыть зажимом выделение водорода.
Основное правило ТБ: работать уверенными руками!
IV. Выполнение практической работы, оформление результатов, уборка рабочего места (23 мин.)
Слайд 6
1. Ученики выполняют практическую работу самостоятельно. Учитель следит за правиль-ностью выполнения техники эксперимента и соблюдением правил ТБ.
2. Уборка рабочего места: после окончания опыта по изучению восстановительных свойств водорода:
1-й ученик: потушить спиртовку, дать пробирке-реактору остыть, затем поставить ее в штатив для пробирок.
2-й ученик: перекрыть выделение газа в автоматическом приборе, вынуть воронку, остатки цинка поместить на фильтровальную бумагу. Вынуть прибор из лапки штатива, слить отра-ботанный раствор в «СКЛЯНКУ ДЛЯ СЛИВА», сдать прибор учителю.
учитель: собирает лотки и кристаллизаторы с водой.
3. Демонстрационный опыт: изучение продукта реакции цинка с соляной киcлотой
Отработанный раствор слить в стакан и несколько капель с помощью стеклянной палочки перенести на стеклянную пластинку. Укрепить пластинку в тигельных щипцах и упарить раствор на пламени
4. Оформить результаты эксперимента: сформулировать и записать наблюдения, вывод (что узнали про газообразное вещество водород на практической работе), сдать тетрадь.
Проведение урока (Фото-фильм)
Использованные электронные пособия:
- Химия (8-11 класс). Виртуальная лаборатория. Лаборатория систем мультимедиа, МарГТУ, 2004.
- Химия для всех XXI. Химические опыты со взрывами и без. Ахлебинин А.К. и др., 2006.
Оформление работы в тетради ученика:
Практическая работа 5: Получение водорода и изучение его свойств
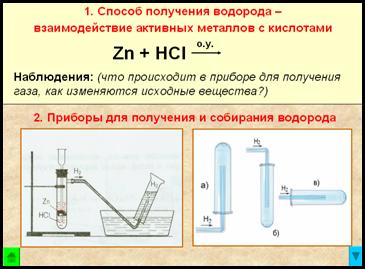
1. Способ получения водорода – взаимодействие активных металлов с кислотами.
Zn + 2HCl = ZnCl2 + Н2↑ + Q — при обычных условиях
- реакция взаимодействия гранул цинка с соляной кислотой идет сначала медленно, затем очень бурно, пробирка разогревается
- из газоотводной трубки выделяется бесцветный газ
- при упаривании полученного раствора на стеклянной пластинке остается белый порошок
2. Приборы для получения и собирания водорода
Рис. Прибор для получения водорода – автоматический, который позволяет в любой момент остановить реакцию с помощью зажима (прибор Кирюшкина).
Собирание газа методом вытеснения воды – возможно, т.к. водород малорастворим в ней.
Рис. Собирание газа методом вытеснения воздуха – держа пробирку-приемник вверх дном, т.к.

3. Обнаружение водорода – проверка его на чистоту
- при сжигании первой порции газа раздается резкий лающий звук
- при сжигании второй порции газа слышен легкий хлопок Рисунок 5 «п-пах»
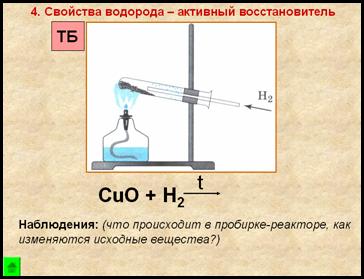
4. Свойство водорода – активный восстановитель
- порошок меняет цвет с черного на медный
- на стенках пробирки появляются бесцветные капельки жидкости
Вывод:
Одним из способов получения водорода в лаборатории является взаимодействие цинка с разб. соляной кислотой, при этом образуется соль (хлорид цинка) и водород. Водород – бесцветный газ, без запаха, малорастворим в воде, легче воздуха, в смеси с воздухом взрывоопасен, восстанавливает металлы из их оксидов.
Урок Практическая работа «Получение водорода и исследование его свойств.»
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Рабочие листы и материалы для учителей и воспитателей
Более 2 500 дидактических материалов для школьного и домашнего обучения
311 лекций для учителей,
воспитателей и психологов
Получите свидетельство
о просмотре прямо сейчас!
Урок 31 Класс 8 —
Тема: Практическая работа № 4 Получение водорода и исследование его свойств.
МБОУ «С(К)ОШ №16», учитель химии Березинская А.А.
- совершенствовать экспериментальные умения — приемы работы с лабораторным оборудованием и веществами; умения наблюдать, делать выводы, оформлять результаты практической работы в тетрад;
- работа над развитием навыков умелого обращения с огнем, опасными веществами.
- умение составлять уравнения химических реакций, умение делать выводы, соблюдать правила техники безопасности;
- расширение кругозора обучающихся, формирование уважения к истории науки.
- развитие представлений о здоровом образе жизни в блоках: «Химия в быту — безопасное поведение».
Коррекционные цели: коррекция и развитие связной устной и письменной речи, коррекция и развитие моторной памяти, развитие умений делать выводы.
- лабораторный штатив с лапкой, держатель для пробирок, штатив для пробирок, ложка-дозатор, фильтровальная бумага
- спиртовка, спички
- автоматический прибор Кирюшкина для получения газов, 3 пробирки, кристаллизатор с водой
гранулы цинка, соляная кислота (разб.), оксид меди (II).
Тип урока : урок- практикум (виртуальная лаборатория)
Правила техники безопасности : Работа со спиртовкой; работа со стеклом; Проверка прибора на герметичность.
I. Подготовка к проведению практической работы.
- Инструктаж по технике безопасности при работе с сухим горючим.
- Технический инструктаж о проведении практической работы.
II. Актуализация знаний
1. Какие исходные вещества будем использовать мы для получения водорода?
2. Необходимо ли нагревать реакционную смесь?
3. На что обратить внимание при записи наблюдений?
4. Какой прибор будем использовать для получения водорода?
5. Какими способами можно собрать водород, почему?
Знакомство с инструкцией: учебник стр. ________
III. Проведение практической работы (просмотр видео: Получение водорода.)
III. Закрепление знаний, умений, навыков.
После проведения работы сделать вывод, записать все результаты в тетрадь.
Домашнее задание: § ________.
Практическая работа № 4.Получение водорода и исследование его свойств.
С правилами ТБ ознакомлен (а)
Цель: научиться получать, собирать водород; изучить физические и химические свойства водорода.
лабораторный штатив с лапкой, держатель для пробирок, штатив для пробирок, ложка-дозатор, фильтровальная бумага,спиртовка, спички, автоматический прибор Кирюшкина для получения газов, 3 пробирки, кристаллизатор с водой.
Реактивы: гранулы цинка, соляная кислота (разб.), оксид меди (II).
1. Способ получения водорода – взаимодействие активных металлов с кислотами.
Zn + 2HCl = ZnCl2 + Н2↑ + Q — при обычных условиях
- реакция взаимодействия гранул цинка с соляной кислотой идет сначала медленно, затем очень бурно, пробирка разогревается
- из газоотводной трубки выделяется бесцветный газ
- при упаривании полученного раствора на стеклянной пластинке остается белый порошок
2. Приборы для получения и собирания водорода
Рис. Прибор для получения водорода – автоматический, который позволяет в любой момент остановить реакцию с помощью зажима (прибор Кирюшкина).
Собирание газа методом вытеснения воды – возможно, т.к. водород малорастворим в ней.

3. Обнаружение водорода – проверка его на чистоту
- при сжигании первой порции газа раздается резкий лающий звук
- при сжигании второй порции газа слышен легкий хлопок Рисунок 5 «п-пах»
4. Свойство водорода – активный восстановитель
- порошок меняет цвет с черного на медный
- на стенках пробирки появляются бесцветные капельки жидкости
Одним из способов получения водорода в лаборатории является взаимодействие цинка с разбавленной соляной кислотой, при этом образуется соль (хлорид цинка) и водород. Водород – бесцветный газ, без запаха, малорастворим в воде, легче воздуха, в смеси с воздухом взрывоопасен, восстанавливает металлы из их оксидов.
Практическая работа №5.
Получение водорода и изучение его свойств.
Цель работы: получить водород в реакции кислоты с металлом, собрать полученный газ и исследовать его свойства.
Реактивы и оборудование: раствор хлороводородной кислоты, гранулы цинка (или кусочки железа), части прибора для получения газов, стаканчик или пробирка с водой, пробирка для собирания водорода, спиртовка, спички, лучинка.
Опыт 1. Получение водорода.
Соберите прибор для получения водорода и проверьте его на герметичность. Положите в пробирку несколько гранул цинка и прилейте к ним небольшой объем (1-2 см 3 ) раствора хлороводородной кислоты. Быстро закройте пробирку пробкой с газоотводной трубкой, конец которой погрузите в стаканчик или пробирку с водой.
Опыт 2. Изучение свойств водорода.
Физические свойства водорода. Наблюдая за протеканием опыта 1, обратите внимание на отсутствие окраски у водорода. Растворяется ли водород в воде?
Химические свойства водорода. Соберите водород. Для этого газоотводную трубку извлеките из воды и введите в пробирку, закрепленную в штативе вверх дном. Вспомните, почему пробирка должна быть расположена именно так. Примерно через 1 минуту осторожно извлеките газоотводную трубку и к отверстию пробирки поднесите горящую лучинку или спичку. Какой признак свидетельствует о протекании химической реакции? Какое химическое свойство проявляет водород в этой реакции?
Составьте отчет о проделанной работе. Сделайте вывод о способе получения водорода в лаборатории, о его физических и химических свойствах, которые вы исследовали. Составьте соответствующие уравнения химических реакций.
ОТВЕТЫ
Опыт 1.
Для цинка
Zn + 2HCl = ZnCl2 + H2
Это реакция замещения. Её продуктами являются хлорид цинка и водород.
Для железа
Fe + 2HCl = FeCl2 + H2
Это реакция замещения. Её продуктами являются хлорид железа (II) и водород.
Опыт 2.
Водород в воде практически нерастворим.
Для собирания водорода пробирку нужно держать вверх дном потому, что водород легче воздуха.
При поднесении горящей лучины (спички) к отверстию пробирки с водородом мы слышим хлопок – происходит взрыв в результате взаимодействия кислорода воздуха с водородом. В результате этой реакции на стенках пробирки можно увидеть капельки прозрачной жидкости – воды.
2H2 + O2 = 2H2
В этой химической реакции водород проявляет свойство горючести.
Вывод: мы научились получать водород в лабораторных условиях путем взаимодействия металла (цинка или железа) с кислотой (хлороводородная кислота). При собирании водорода пробирку держат дном вверх, т.к. водород легче воздуха.
Физические свойства водорода: газ без цвета и запаха, нерастворим в воде, легче воздуха.
Химические свойства водорода: при поджигании происходит взрывная реакция горения с кислородом воздуха с образованием воды.
Урок 26. Получение водорода и его применение
В уроке 26 «Получение водорода и его применение» из курса «Химия для чайников» узнаем о получении водорода в лабораториях и в промышленности, а также выясним в каких отраслях промышленности его применяют.
Водород находит широкое применение в технике и лабораторных исследованиях. Мировое промышленное производство водорода из меряется десятками миллионов тонн в год.
Выбор промышленного способа получения простых веществ зависит от того, в какой форме соответствующий элемент находится в природе. Водород находится в природе преимущественно в соединениях с атомами других элементов. Поэтому для его получения необходимо использовать химические методы. Эти же методы применяют для получения водорода и в лабораторной практике.
Получение водорода в лаборатории
В лабораториях водород получают уже известным вам способом, действуя кислотами на металлы: железо, цинк и др. Поместим на дно пробирки три гранулы цинка и прильем небольшой объем соляной кислоты. Там, где кислота соприкасается с цинком (на поверхности гранул), появляются пузырьки бесцветного газа, которые быстро поднимаются к поверхности раствора:
Атомы цинка замещают атомы водорода в молекулах кислоты, в результате чего образуется простое вещество водород Н2, пузырьки которого выделяются из раствора. Для получения водорода таким способом можно использовать не только хлороводородную кислоту и цинк, но и некоторые другие кислоты и металлы.
Соберем водород методом вытеснения воздуха, располагая пробирку вверх дном (объясните почему), или методом вытеснения воды и проверим его на чистоту. Пробирку с собранным водородом наклоняем к пламени спиртовки. Глухой хлопок свидетельствует о том, что водород чистый; «лающий» громкий звук взрыва говорит о загрязненности его примесью воздуха.
В химических лабораториях для получения относительно небольших объемов водорода обычно применяют способ разложения воды с помощью электрического тока:
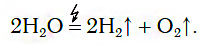
Из уравнения процесса разложения следует, что из 2 моль воды образуются 2 моль водорода и 1 моль кислорода. Следовательно, и соотношение объемов этих газов также равно:
Получение водорода в промышленности
Очевидно, что при огромных объемах промышленного производства сырьем для получения водорода должны быть легкодоступные и дешевые вещества. Такими веществами являются природный газ (метан СН4) и вода. Запасы природного газа очень велики, а воды — практически неограниченны.
Самый дешевый способ получения водорода — разложение метана при нагревании:
Эту реакцию проводят при температуре около 1000 °С.
В промышленности водород также получают, пропуская водяные пары над раскаленным углем:
Существуют и другие промышленные способы получения водорода.
Применение водорода
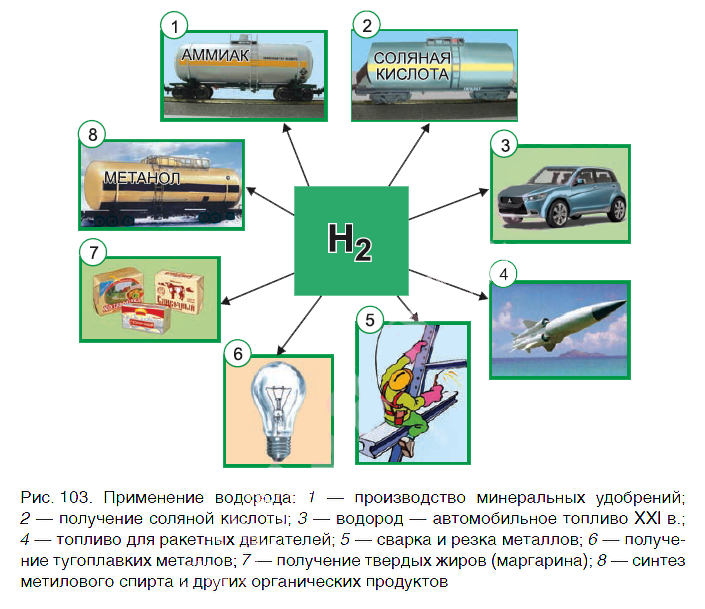
Водород находит широкое практическое применение. Основные области его промышленного использования показаны на рисунке 103.
Значительная часть водорода идет на переработку нефти. Около 25 % производимого водорода расходуется на синтез аммиака NH3. Это один из важнейших продуктов химической промышленности. Производство аммиака и азотных удобрений на его основе осуществляется в нашей стране на ОАО «Гродно Азот». Республика Беларусь поставляет азотные удобрения во многие страны мира.
В большом количестве водород расходуется на получение хлороводородной кислоты. Реакция горения водорода в
кислороде используется в ракетных двигателях, выводящих в космос летательные аппараты. Водород применяют и для получения металлов из оксидов. Таким способом получают тугоплавкие металлы молибден и вольфрам.
В пищевой промышленности водород используют в производстве маргарина из растительных масел. Реакцию горения водорода в кислороде применяют для сварочных работ. Если использовать специальные горелки, то можно повысить температуру пламени до 4000 о С. При такой температуре проводят сварочные работы с самыми тугоплавкими материалами.
В настоящее время в ряде стран, в том числе и в Беларуси, начаты исследования по замене невозобновляемых источников энергии (нефти, газа, угля) на водород. При сгорании водорода в кислороде образуется экологически чистый продукт — вода. А углекислый газ, вызывающий парниковый эффект (потепление окружающей среды), не выделяется.
Предполагают, что с середины XXI в. должно быть начато серийное производство автомобилей на водороде. Широкое применение найдут домашние топливные элементы, работа которых также основана на окислении водорода кислородом.
Краткие выводы урока:
- В лаборатории водород получают действием кислот на металлы.
- В промышленности для получения водорода используют доступное и дешевое сырье — природный газ, воду.
- Водород — это перспективный источник энергии XXI в.
Надеюсь урок 26 «Получение водорода и его применение» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
источники:
http://infourok.ru/urok-prakticheskaya-rabota-poluchenie-vodoroda-i-issledovanie-ego-svoystv-3592063.html
http://himgdz.ru/gdz-shimanovich-7-2017-p5/
http://himi4ka.ru/arhiv-urokov/urok-26-poluchenie-vodoroda-i-ego-primenenie.html
В уроке 26 «Получение водорода и его применение» из курса «Химия для чайников» узнаем о получении водорода в лабораториях и в промышленности, а также выясним в каких отраслях промышленности его применяют.
Водород находит широкое применение в технике и лабораторных исследованиях. Мировое промышленное производство водорода из меряется десятками миллионов тонн в год.
Выбор промышленного способа получения простых веществ зависит от того, в какой форме соответствующий элемент находится в природе. Водород находится в природе преимущественно в соединениях с атомами других элементов. Поэтому для его получения необходимо использовать химические методы. Эти же методы применяют для получения водорода и в лабораторной практике.
Получение водорода в лаборатории
В лабораториях водород получают уже известным вам способом, действуя кислотами на металлы: железо, цинк и др. Поместим на дно пробирки три гранулы цинка и прильем небольшой объем соляной кислоты. Там, где кислота соприкасается с цинком (на поверхности гранул), появляются пузырьки бесцветного газа, которые быстро поднимаются к поверхности раствора:
Атомы цинка замещают атомы водорода в молекулах кислоты, в результате чего образуется простое вещество водород Н2, пузырьки которого выделяются из раствора. Для получения водорода таким способом можно использовать не только хлороводородную кислоту и цинк, но и некоторые другие кислоты и металлы.
Соберем водород методом вытеснения воздуха, располагая пробирку вверх дном (объясните почему), или методом вытеснения воды и проверим его на чистоту. Пробирку с собранным водородом наклоняем к пламени спиртовки. Глухой хлопок свидетельствует о том, что водород чистый; «лающий» громкий звук взрыва говорит о загрязненности его примесью воздуха.
В химических лабораториях для получения относительно небольших объемов водорода обычно применяют способ разложения воды с помощью электрического тока:
Из уравнения процесса разложения следует, что из 2 моль воды образуются 2 моль водорода и 1 моль кислорода. Следовательно, и соотношение объемов этих газов также равно:
Получение водорода в промышленности
Очевидно, что при огромных объемах промышленного производства сырьем для получения водорода должны быть легкодоступные и дешевые вещества. Такими веществами являются природный газ (метан СН4) и вода. Запасы природного газа очень велики, а воды — практически неограниченны.
Самый дешевый способ получения водорода — разложение метана при нагревании:
Эту реакцию проводят при температуре около 1000 °С.
В промышленности водород также получают, пропуская водяные пары над раскаленным углем:
Существуют и другие промышленные способы получения водорода.
Применение водорода
Водород находит широкое практическое применение. Основные области его промышленного использования показаны на рисунке 103.
Значительная часть водорода идет на переработку нефти. Около 25 % производимого водорода расходуется на синтез аммиака NH3. Это один из важнейших продуктов химической промышленности. Производство аммиака и азотных удобрений на его основе осуществляется в нашей стране на ОАО «Гродно Азот». Республика Беларусь поставляет азотные удобрения во многие страны мира.
В большом количестве водород расходуется на получение хлороводородной кислоты. Реакция горения водорода в
кислороде используется в ракетных двигателях, выводящих в космос летательные аппараты. Водород применяют и для получения металлов из оксидов. Таким способом получают тугоплавкие металлы молибден и вольфрам.
В пищевой промышленности водород используют в производстве маргарина из растительных масел. Реакцию горения водорода в кислороде применяют для сварочных работ. Если использовать специальные горелки, то можно повысить температуру пламени до 4000 оС. При такой температуре проводят сварочные работы с самыми тугоплавкими материалами.
В настоящее время в ряде стран, в том числе и в Беларуси, начаты исследования по замене невозобновляемых источников энергии (нефти, газа, угля) на водород. При сгорании водорода в кислороде образуется экологически чистый продукт — вода. А углекислый газ, вызывающий парниковый эффект (потепление окружающей среды), не выделяется.
Предполагают, что с середины XXI в. должно быть начато серийное производство автомобилей на водороде. Широкое применение найдут домашние топливные элементы, работа которых также основана на окислении водорода кислородом.
Краткие выводы урока:
- В лаборатории водород получают действием кислот на металлы.
- В промышленности для получения водорода используют доступное и дешевое сырье — природный газ, воду.
- Водород — это перспективный источник энергии XXI в.
Надеюсь урок 26 «Получение водорода и его применение» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
1. Какой способ получения кислорода вы будете использовать во время работы? Составьте уравнение соответствующей реакции.
Разложение пероксида водорода.
2H2O2 ->MnO2 2H2O + O2
2. Какие физические свойства кислорода вы обнаружите, выполняя опыт №1 «Получение и собирание кислорода»?
Безцветный газ, без запаха, тяжелее воздуха.
3. Каким образом можно обнаружить кислород в стакане (цилиндре)? На каком свойстве кислорода основан этот способ идентификации?
Тлеющая лучинка вспыхивает. Кислород поддерживает горение.
4. Какие химические свойства кислорода вы исследуете во втором опыте? Составьте уравнения соответствующих реакций.
С+О2 ->СО2
СО2+Са(ОН)2 -> СаСО3+Н2О
5. Сформулируйте цель и выводы к работе.
Цель: Получить кислород при помощи разделения пероксида, изучить свойства кислорода.
Вывод: кислород можно получить при нагревании перекиси водорода в присутствии MnO2, как катализатора. Кислород — газ, который поддерживает горение, при горении образуются оксиды.
Сохраните или поделитесь с одноклассниками:
Урок
31 Класс
8 —
Тема:
Практическая работа № 4 Получение водорода и
исследование его свойств.
Дата
____________20
МБОУ
«С(К)ОШ №16», учитель химии Березинская А.А.
Цель:
- совершенствовать
экспериментальные умения — приемы работы с лабораторным оборудованием и
веществами; умения наблюдать, делать выводы, оформлять результаты
практической работы в тетрад; - работа
над развитием навыков умелого обращения с огнем, опасными веществами. - умение
составлять уравнения химических реакций, умение делать выводы, соблюдать
правила техники безопасности; - расширение
кругозора обучающихся, формирование уважения к истории науки. - развитие
представлений о здоровом образе жизни в блоках: «Химия в быту — безопасное
поведение».
Коррекционные
цели: коррекция
и развитие связной устной и письменной речи, коррекция и развитие моторной
памяти, развитие умений делать выводы.
Оборудование:
- лабораторный
штатив с лапкой, держатель для пробирок, штатив для пробирок,
ложка-дозатор, фильтровальная бумага - спиртовка,
спички - автоматический
прибор Кирюшкина для получения газов, 3 пробирки, кристаллизатор с водой
Реактивы:
гранулы
цинка, соляная кислота (разб.), оксид меди (II).
Тип
урока: урок- практикум (виртуальная лаборатория)
Правила
техники безопасности: Работа
со спиртовкой; работа со стеклом; Проверка прибора на герметичность.
Ход работы:
I. Подготовка к проведению
практической работы.
- Инструктаж по
технике безопасности при работе с сухим горючим. - Технический
инструктаж о проведении практической работы.
II. Актуализация
знаний
1. Какие исходные вещества будем использовать мы для получения
водорода?
2. Необходимо ли нагревать реакционную смесь?
3. На что обратить внимание при записи наблюдений?
4. Какой прибор будем использовать для получения водорода?
5. Какими способами можно собрать водород, почему?
Знакомство с инструкцией:
учебник стр. ________
III. Проведение практической
работы (просмотр видео: Получение водорода.)
III. Закрепление знаний,
умений, навыков.
После проведения работы сделать вывод, записать все результаты в
тетрадь.
Домашнее задание: §
________.
Практическая работа № 4.Получение водорода и
исследование его свойств.
С правилами ТБ ознакомлен (а)
Цель:
научиться получать, собирать водород; изучить
физические и химические свойства водорода.
Оборудование:
лабораторный штатив с лапкой, держатель
для пробирок, штатив для пробирок, ложка-дозатор, фильтровальная бумага,спиртовка,
спички, автоматический прибор Кирюшкина для получения газов, 3 пробирки,
кристаллизатор с водой.
Реактивы: гранулы
цинка, соляная кислота (разб.), оксид меди (II).
Ход
работы
1.
Способ получения водорода – взаимодействие активных металлов с кислотами.
Zn + 2HCl = ZnCl2 +
Н2↑ + Q — при обычных условиях
Наблюдения:
- реакция
взаимодействия гранул цинка с соляной кислотой идет сначала медленно,
затем очень бурно, пробирка разогревается - из
газоотводной трубки выделяется бесцветный газ - при
упаривании полученного раствора на стеклянной пластинке остается белый
порошок
2. Приборы для получения и собирания
водорода

Рис. Прибор для получения водорода –
автоматический, который позволяет в любой момент остановить реакцию с помощью
зажима (прибор Кирюшкина).
Собирание газа методом вытеснения воды –
возможно, т.к. водород малорастворим в ней.
–
следовательно, водород легче воздуха
3. Обнаружение водорода – проверка его на
чистоту
Наблюдения:
- при сжигании
первой порции газа раздается резкий лающий звук - при сжигании
второй порции газа слышен легкий хлопок Рисунок 5 «п-пах»
4. Свойство водорода – активный
восстановитель
Наблюдения:
- порошок
меняет цвет с черного на медный - на стенках
пробирки появляются бесцветные капельки жидкости
Вывод:
Одним из способов получения водорода в
лаборатории является взаимодействие цинка с разбавленной соляной кислотой, при
этом образуется соль (хлорид цинка) и водород. Водород – бесцветный газ, без
запаха, малорастворим в воде, легче воздуха, в смеси с воздухом взрывоопасен,
восстанавливает металлы из их оксидов.
Место урока: 8 класс. Тема II: Кислород, водород, вода как растворитель.
Тип урока: практическая работа
Задачи:
- Образовательная – совершенствовать экспериментальные умения — приемы работы с лабораторным оборудованием и веществами; умения наблюдать, делать выводы, оформлять результаты практической работы в тетради.
- Развивающая – работа над развитием навыков умелого обращения с огнем, опасными веществами.
- Воспитательная – расширение кругозора обучающихся, формирование уважения к истории науки.
- Здоровьесберегающая – развитие представлений о здоровом образе жизни в блоках: «Химия в быту — безопасное поведение»
Планируемые результаты обучения:
- Уметь работать с автоматическим прибором Кирюшкина для получения газов
- Уметь собирать газ методом вытеснения воды
- Уметь проверять горючий газ на чистоту
- Уметь делать правильные выводы из наблюдаемых опытов и характеризовать свойства водорода
Оборудование:
- Мультимедийная презентация 2 (Microsoft Power Point)
- Спецодежда — халат
- Наполняемость лабораторного лотка для ученика (13 шт.)
- лабораторный штатив с лапкой, держатель для пробирок, штатив для пробирок, ложка-дозатор, фильтровальная бумага
- спиртовка, спички
- автоматический прибор Кирюшкина для получения газов, 3 пробирки, кристаллизатор с водой
- гранулы цинка, соляная кислота (разб.), оксид меди (II)
- Наполняемость лабораторного лотка для учителя:
- лоток для ученика
- тигельные щипцы, стакан, стеклянная пластинка, стеклянная палочка
- «результаты» нарушений правил техники безопасности
Методы и приемы:
- Словесные (рассказ учителя, беседа).
- Наглядные (просмотр слайдов презентации; демонстрация приемов работы с лаборатор-ным оборудованием и веществами).
- Самостоятельная отработка учеником экспериментальных умений.
- Проблемно-поисковый.
Ход урока
(курсивом описаны действия учеников и учителя, особенности методики урока; обычным шрифтом – речь учителя)
I. Организационный момент (1 мин.)
отметить наличие халатов у всех учеников, проверить свободны ли от сумок проходы, убраны ли волосы у девочек. На столах оставить только ручки, калькуляторы и тетради.
II. Активизация знаний, необходимых для выполнения практической работы (13 мин.)
Слайд 1:
На этом уроке мы получим водород в лабораторных условиях. Это газообразное вещество; является взрывоопасным, если загрязнено воздухом, и поэтому требует к себе повышенного внимания.
Ученики одновременно с обсуждением расписываются в журнале техники безопасности.
Слайд 2:
Ознакомление с планом урока. I.
На предыдущем уроке была проведена подготовка учеников к данной практической работе (Презентация 1) и задано домашнее задание:
Слайд 3:
Слайд проявляется постепенно, в соответствии с беседой
Вопросы:
- Какие исходные вещества будем использовать мы для получения водорода?
- Необходимо ли нагревать реакционную смесь?
- На что обратить внимание при записи наблюдений?
- Какой прибор будем использовать для получения водорода?
- Какими способами можно собрать водород, почему?
Слайд 4:
Слайд проявляется постепенно, в соответствии с беседой
Вопросы:
- Как доказать наличие водорода в пробирке-приёмнике?
- Какая химическая реакция происходит при этом?
- На что обратить внимание при записи наблюдений в данном пункте работы?
- Что из себя представляет гремучий газ?
Просмотр двух видеороликов.
Если взрыв произойдет в стеклянном сосуде, то осколки могут поранить окружающих и экспериментатора.
При проверке водорода на чистоту сжигают небольшой его объем (около 15 мл).
Возможный микровзрыв к травме привести не может.
Правило ТБ: пока нет убежденности, что газ из прибора выделяется чистый, держать отверстие газоотводной трубки подальше от пламени спиртовки.
Слайд 5:
Демонстрация результатов нарушений правил ТБ: пробирка с растресканным дном
Правило ТБ: нагревать пробирку необходимо в том месте, где находится твердое вещество, а не выше – где воздух. От неравномерного нагрева пробирка треснет.
пробирка со следами соляной кислоты в смеси с оксидом меди (II)
Правило ТБ: при зарядке автоматического прибора соляной кислотой нужно следить, чтобы не перелить кислоту (max 2 мл), иначе избыток от экзотермичности и бурного течения процесса попадет в газоотводную трубку.
III. Демонстрация эксперимента учителем (7 мин.)
Слайд 6
Слово учителя с элементами беседы
1. Взять ложкой-дозатором небольшое количество черного порошка оксида меди (II), поместить в пробирку, оставить в штативе для пробирок до проведения опыта по изучению восстановительных свойств водорода.
2. Закрепить автоматический прибор для получения газов в лапке штатива. Зарядить прибор исходными веществами: 4-5 гранул цинка поместить на резиновый кружок, через воронку прилить соляную кислоту так, чтобы ее слой над цинком был не более 2 мл. Прибор закрыть максимально герметично.
3. Для проверки газа на чистоту, мне приходится приготовить спиртовку заранее. Вы работаете вдвоем и зажжете спиртовку после того, как наберете газ в пробирку- приемник.
Правила ТБ: работа со спиртовкой
а) прежде чем зажечь спиртовку, нужно проверить плотно ли диск прилегает к отверстию резервуара (иначе искра может попасть в резервуар и весь объем спирта воспламенится)
б) зажигать только спичкой (нельзя использовать зажигалку, другую спиртовку)
в) спичку класть в лоток следует, убедившись, что она затушена (демонстрация нарушения правил ТБ – прожженный лоток)
г) чтобы погасить пламя, ее следует закрыть колпачком (задувать нельзя)
Выделяющийся водород собрать методом вытеснения воздуха, держа пробирку-приёмник вверх дном. Проверить газ на чистоту: зажать отверстие пробирки пальцем и поднести пробирку к пламени спиртовки, открыть ее.
4. Затем выделяющийся водород собрать методом вытеснения воды: набрать полную пробирку воды, перевернуть ее в кристаллизаторе и подвести к отверстию газоотводную трубку. Когда пробирка-приемник полностью заполнится водородом, зажать отверстие пальцем под водой. Убедиться в чистоте газа.
5. Закрепить пробирку с оксидом меди (II) в держателе.
Правила ТБ: закрепление пробирки в держателе
а) пробирку закрепляют в верхней третьей части ближе к отверстию
б) пробирка не должна выпадать, но проворачиваться (иначе при нагревании стекло расширяется и пробирка может лопнуть)
в) чтобы вынуть пробирку из держателя, нужно ослабить зажим.
Прогреть пробирку на пламени спиртовки 2-3 раза, далее нагревать ее в верхней части пламени, в том месте, где находится оксид меди (II). Внести газоотводную трубку с выделяющимся водородом.
После окончания опыта дать пробирке остыть, затем поставить в штатив для пробирок.
6. Потушить спиртовку, перекрыть зажимом выделение водорода.
Основное правило ТБ: работать уверенными руками!
IV. Выполнение практической работы, оформление результатов, уборка рабочего места (23 мин.)
Слайд 6
1. Ученики выполняют практическую работу самостоятельно. Учитель следит за правиль-ностью выполнения техники эксперимента и соблюдением правил ТБ.
2. Уборка рабочего места: после окончания опыта по изучению восстановительных свойств водорода:
1-й ученик: потушить спиртовку, дать пробирке-реактору остыть, затем поставить ее в штатив для пробирок.
2-й ученик: перекрыть выделение газа в автоматическом приборе, вынуть воронку, остатки цинка поместить на фильтровальную бумагу. Вынуть прибор из лапки штатива, слить отра-ботанный раствор в «СКЛЯНКУ ДЛЯ СЛИВА», сдать прибор учителю.
учитель: собирает лотки и кристаллизаторы с водой.
3. Демонстрационный опыт: изучение продукта реакции цинка с соляной киcлотой
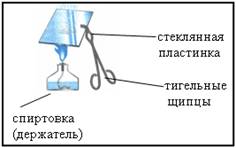
Отработанный раствор слить в стакан и несколько капель с помощью стеклянной палочки перенести на стеклянную пластинку. Укрепить пластинку в тигельных щипцах и упарить раствор на пламени
Что наблюдается?
4. Оформить результаты эксперимента: сформулировать и записать наблюдения, вывод (что узнали про газообразное вещество водород на практической работе), сдать тетрадь.
Проведение урока (Фото-фильм)
Использованные электронные пособия:
- Химия (8-11 класс). Виртуальная лаборатория. Лаборатория систем мультимедиа, МарГТУ, 2004.
- Химия для всех XXI. Химические опыты со взрывами и без. Ахлебинин А.К. и др., 2006.
Оформление работы в тетради ученика:
Практическая работа 5: Получение водорода и изучение его свойств
1. Способ получения водорода – взаимодействие активных металлов с кислотами.
Zn + 2HCl = ZnCl2 + Н2↑ + Q — при обычных условиях
Наблюдения:
- реакция взаимодействия гранул цинка с соляной кислотой идет сначала медленно, затем очень бурно, пробирка разогревается
- из газоотводной трубки выделяется бесцветный газ
- при упаривании полученного раствора на стеклянной пластинке остается белый порошок
2. Приборы для получения и собирания водорода
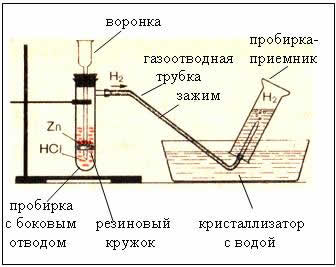
Рис. Прибор для получения водорода – автоматический, который позволяет в любой момент остановить реакцию с помощью зажима (прибор Кирюшкина).
Собирание газа методом вытеснения воды – возможно, т.к. водород малорастворим в ней.
Рис. Собирание газа методом вытеснения воздуха – держа пробирку-приемник вверх дном, т.к.
– следовательно, водород легче воздуха
3. Обнаружение водорода – проверка его на чистоту
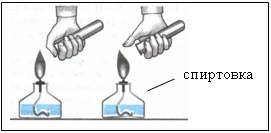
Наблюдения:
- при сжигании первой порции газа раздается резкий лающий звук
- при сжигании второй порции газа слышен легкий хлопок Рисунок 5 «п-пах»
4. Свойство водорода – активный восстановитель
Наблюдения:
- порошок меняет цвет с черного на медный
- на стенках пробирки появляются бесцветные капельки жидкости
Вывод:
Одним из способов получения водорода в лаборатории является взаимодействие цинка с разб. соляной кислотой, при этом образуется соль (хлорид цинка) и водород. Водород – бесцветный газ, без запаха, малорастворим в воде, легче воздуха, в смеси с воздухом взрывоопасен, восстанавливает металлы из их оксидов.
Получение водорода и изучение его свойств.
Цель работы: получить водород в реакции кислоты с металлом, собрать полученный газ и исследовать его свойства.
Реактивы и оборудование: раствор хлороводородной кислоты, гранулы цинка (или кусочки железа), части прибора для получения газов, стаканчик или пробирка с водой, пробирка для собирания водорода, спиртовка, спички, лучинка.
Опыт 1. Получение водорода.
Соберите прибор для получения водорода и проверьте его на герметичность. Положите в пробирку несколько гранул цинка и прилейте к ним небольшой объем (1-2 см3) раствора хлороводородной кислоты. Быстро закройте пробирку пробкой с газоотводной трубкой, конец которой погрузите в стаканчик или пробирку с водой.

Опыт 2. Изучение свойств водорода.
Физические свойства водорода. Наблюдая за протеканием опыта 1, обратите внимание на отсутствие окраски у водорода. Растворяется ли водород в воде?
Химические свойства водорода. Соберите водород. Для этого газоотводную трубку извлеките из воды и введите в пробирку, закрепленную в штативе вверх дном. Вспомните, почему пробирка должна быть расположена именно так. Примерно через 1 минуту осторожно извлеките газоотводную трубку и к отверстию пробирки поднесите горящую лучинку или спичку. Какой признак свидетельствует о протекании химической реакции? Какое химическое свойство проявляет водород в этой реакции?
Составьте отчет о проделанной работе. Сделайте вывод о способе получения водорода в лаборатории, о его физических и химических свойствах, которые вы исследовали. Составьте соответствующие уравнения химических реакций.
ОТВЕТЫ
Опыт 1.
Для цинка
Zn + 2HCl = ZnCl2 + H2
Это реакция замещения. Её продуктами являются хлорид цинка и водород.
Для железа
Fe + 2HCl = FeCl2 + H2
Это реакция замещения. Её продуктами являются хлорид железа (II) и водород.
Опыт 2.
Водород в воде практически нерастворим.
Для собирания водорода пробирку нужно держать вверх дном потому, что водород легче воздуха.
При поднесении горящей лучины (спички) к отверстию пробирки с водородом мы слышим хлопок – происходит взрыв в результате взаимодействия кислорода воздуха с водородом. В результате этой реакции на стенках пробирки можно увидеть капельки прозрачной жидкости – воды.
2H2 + O2 = 2H2
В этой химической реакции водород проявляет свойство горючести.
Вывод: мы научились получать водород в лабораторных условиях путем взаимодействия металла (цинка или железа) с кислотой (хлороводородная кислота). При собирании водорода пробирку держат дном вверх, т.к. водород легче воздуха.
Физические свойства водорода: газ без цвета и запаха, нерастворим в воде, легче воздуха.
Химические свойства водорода: при поджигании происходит взрывная реакция горения с кислородом воздуха с образованием воды.